Februar 9th, 2019 by Chemiker
Von der Osmose sollte man schon einmal etwas gehört haben, schließlich funktioniert dank ihr die Regulierung des Wasserhaushalts der Zellen und so auch der Stofftransport im Organismus. Sie ist damit essentiell für Pflanzen, Menschen und andere Lebewesen.
Weiter lesen »
Posted in Grundlagen | No Comments »
Dezember 10th, 2011 by Chemiker
Viele Laugen im Alltag können durch Experimente, die auch im Schulunterricht möglich sind, nachvollzogen werden. Von der Herstellung einer Lauge bis hin zum Nachweis von Laugen über einen Indikator ist alles möglich. Und auch darüber hinaus bieten Laugen eine Vielzahl an Anwendungsmöglichkeiten. Nachfolgend sollen zwei Experimente zu Anwendungen von Laugen beschrieben werden, auf die wir auch im Alltag häufig treffen. Weiter lesen »
Posted in Laugen | No Comments »
November 19th, 2011 by Chemiker
Das Ammoniakwasser (auch Ammoniaklösung oder Salmiakgeist genannt) entsteht beim Lösen des Gases Ammoniak in Wasser:
NH3 + H2O -> NH4+ + OH–
Wie man an der Reaktionsgleichung sieht, entstehen Ammoniumionen NH4+ und Hydroxidionen OH–
Das Ammoniakwasser kann Fette lösen und und organische Substanzen aufquellen. Es ist daher ein Hausmittel zur Reinigung von Oberflächen. Auch zur Abwehr von Wespen kann Salmiakgeist verwendet werden. In der Nahrungsmittelindustrie wird Ammoniakwasser für die Produktion von Nahrungsmitteln wie Hefen und Vitaminen benötigt.
Posted in Laugen | No Comments »
Oktober 16th, 2011 by Chemiker
Die Kalilauge ist die wässrige Lösung des Kaliumhydroxids (auch Ätzkali genannt) KOH:
KOH –Wasser-> K+ + OH–
Wie die Natronlauge, ist auch die Kalilauge eine sehr starke Lösung. Das Kaliumhydroxid besitzt ähnliche Eigenschaften wie Natriumhydroxid. Weiter lesen »
Posted in Laugen | No Comments »
Oktober 2nd, 2011 by Chemiker
Kalkwasser ist die Bezeichnung für die wässrige Lösung des Calciumhydroxids (auch gelöschter Kalk genannt) Ca(OH)2:
Ca(OH)2 –Wasser-> Ca+ + 2OH–
Im Vergleich zur Natron- und Kalilaugen ist Kalkwasser eine mittelstarke Lauge. Weiter lesen »
Posted in Laugen | No Comments »
September 2nd, 2011 by Chemiker
Unter dem Begriff Natronlauge versteht man die wässrige Lösung des Natriumhydroxids NaOH:
NaOH –Wasser-> Na+ + OH–
Die Natronlauge zählt sich zu den stärksten Laugen. Sie weicht tierische und pflanzliche Stoffe erst auf und löst sie anschließend. Deshalb findet man Natronlauge im Alltag oft in Putzmitteln wie Geschirrspülmittel, Rohrfrei Reinigern, aber auch in Lebensmitteln, wie der Laugenbrezel, ist Natronlauge enthalten. Weiter lesen »
Posted in Laugen | No Comments »
August 18th, 2011 by Chemiker
Um die Bildung von Natronlauge zu demonstrieren, gibt man in eine Glaswanne die mit Wasser gefüllt ist, auf die Oberfläche ein kleines Stück Natrium. Natrium zeigt mit Wasser eine hohe Reaktivität, dementsprechend sollte zum Schutz vor Spritzer, durch das auf der Wasseroberflächende herumzischende Natrium, eine Schutzbrille getragen werden. Nach dem das Natrium durch eine helle Flamme verbrannt ist, kann mit einem Indikator die Lauge nachgewiesen werden. So würde sich ein Lackmuspapier blau färben und damit anzeigen, dass das Wasser alkalisch geworden ist.
Posted in Laugen | No Comments »
August 12th, 2011 by Chemiker
Laugen können über verschiedene Wege gebildet werden. So entstehen beispielsweise Laugen beim Lösen von wasserlöslichen Metalloxiden im Wasser:
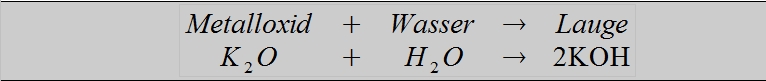
Außerdem können Laugen gebildet werden, wenn die unedlen Metalle Natrium, Kalium und Calcium direkt mit Wasser reagieren: Weiter lesen »
Posted in Laugen | 6 Comments »
Juli 28th, 2011 by Chemiker
Nahezu alle Laugen besitzen gemeinsame Eigenschaften die sie auszeichnen. Dies sind unter anderem:
- Charakteristische Färbung mit Indikatoren (z.B. Blaufärbung von Lackmus)
- Fühlen sich auf der Haut glitschig/seifig an
- Lösungen sind ätzend
- Zeigen elektrische Leitfähigkeit
- PH-Wert der Laugen liegt oberhalb des Neutralpunkts 7
- Laugen lassen sich mit Säuren neutralisieren
- Sie haben eine -OH Gruppe (Hydroxid)
Posted in Laugen | 5 Comments »
Juli 7th, 2011 by Chemiker
Ein anderer Begriff für das Wort Lauge ist alkalische Lösung. Damit sind Laugen streng genommen nichts anderes als wässrige Lösungen von Alkalihydroxiden/Metallhydroxiden wie:
- Lithiumhydroxid (LiOH)
- Natriumhydroxid (NaOH)
- Kaliumhydroxid (KOH)
- Rubidiumhydroxid (RbOH)
- Caesiumhydroxid (CsOH)
Wie man an den Verhältnisformeln der aufgeführten Alkalihydroxiden erkennen kann, setzen sich diese aus Alkalimetall-Ionen und Hydroxidionen (OH) zusammen.
Im weiteren Sinne versteht man unter dem Begriff „alkalische Lösung“ auch jede Lösung von Basen.
Im Umkehrschluss erhält man die oben genannten Metallhydroxide, indem man die Laugen eindampft.
Posted in Laugen | No Comments »